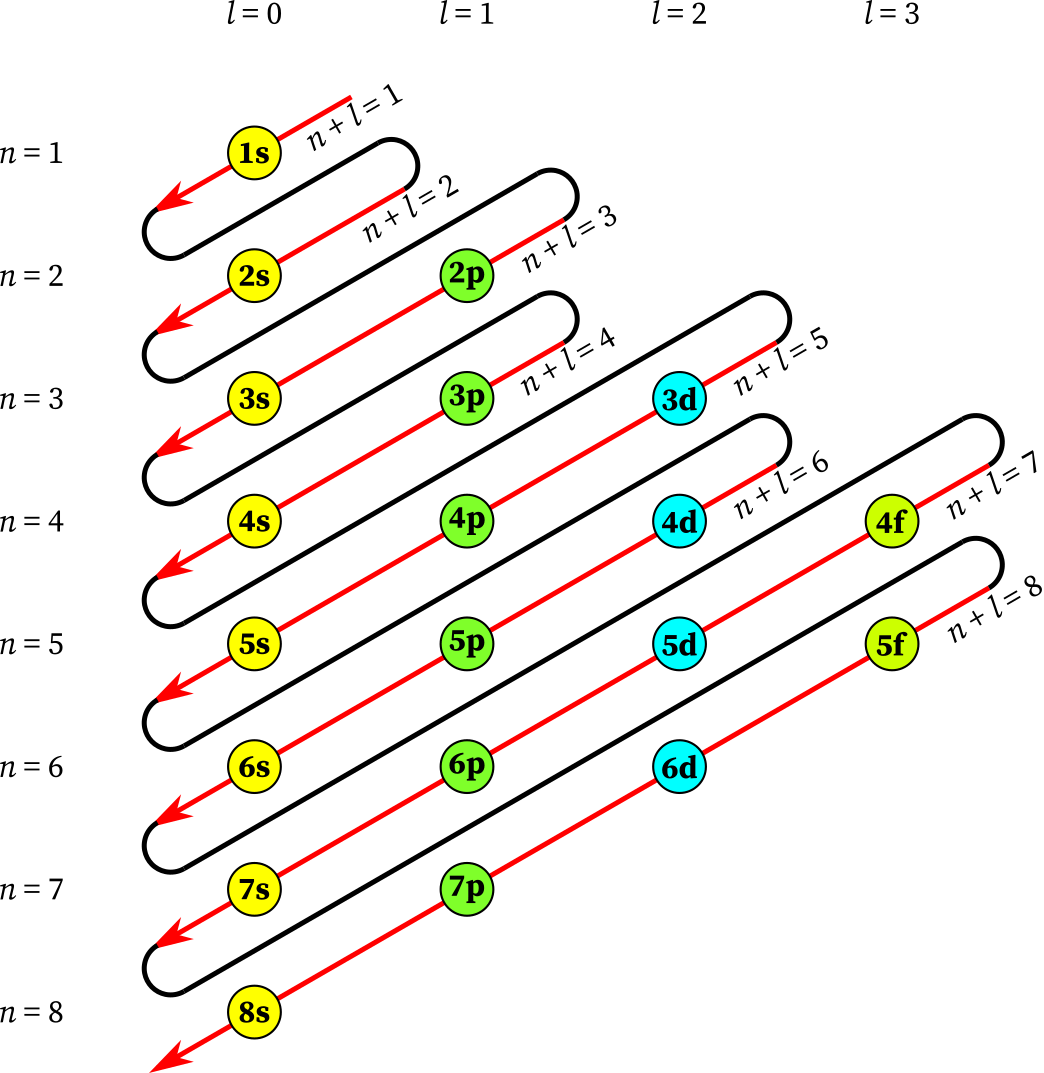
El esquema de Aufbau, también conocido como la regla de Aufbau, es fundamental en química para comprender la estructura electrónica de los átomos y su relación con la distribución de los electrones en los diferentes niveles y subniveles. La campana de Aufbau es esencial en este proceso.
El término «Aufbau» proviene del alemán y se traduce como «construcción». El esquema de Aufbau es un modelo teórico que nos ayuda a entender cómo se llenan los orbitales de los átomos a medida que se añaden más y más electrones. Estos orbitales son arreglos tridimensionales en los que los electrones se encuentran en el átomo. La tabla de Aufbau nos guía en este proceso. El diagrama de aufbau química nos permite visualizar esta distribución. Además, es importante mencionar el «aufbau que es», que se refiere a la metodología utilizada en este proceso de llenado de orbitales. Para facilitar la comprensión, también podemos referirnos al principio de construcción de aufbau, que establece el orden en el que se llenan los orbitales.
Índice de contenido
La estructura del átomo y los niveles de energía
Para comprender el esquema de Aufbau, primero debemos entender la estructura básica del átomo. Un átomo consta de un núcleo, que contiene protones y neutrones, y electrones que orbitan alrededor del núcleo en niveles de energía. El diagrama de aufbau quimica nos ayuda a visualizar esta estructura.
Los niveles de energía en un átomo se representan por números llamados números cuánticos principales (n). Estos números cuánticos principales determinan la energía del nivel y el tamaño del orbital, y también nos indican la distancia promedio del electrón al núcleo. A medida que el número n aumenta, la distancia promedio del electrón al núcleo también aumenta.
El nivel 1 tiene un único orbital, llamado 1s, mientras que el nivel 2 tiene un 2s orbital y tres orbitales 2p. A medida que subimos en los niveles, los orbitales se vuelven más complejos y numerosos. La tabla aufbau nos muestra esta progresión.
La regla de construcción de Aufbau
El esquema de Aufbau nos indica el orden en que los electrones llenan los orbitales a medida que se añaden más electrones al átomo. Esta regla de construcción, también conocida como «regla de Aufbau», se basa en el principio de que los electrones buscan ocupar los orbitales más bajos de energía antes de llenar los orbitales de mayor energía. La campana de Aufbau guía esta distribución.
Según la regla de construcción de Aufbau, los electrones se llenan en orden creciente de energía, comenzando por el nivel 1 y avanzando hacia los niveles superiores. Dentro de cada nivel, los electrones llenan los subniveles en el siguiente orden: 1s, 2s, 2p, 3s, 3p y así sucesivamente. Esta regla es fundamental para comprender la estructura de los átomos.
El llenado de los orbitales
Empecemos por analizar el llenado de los orbitales en el nivel 1. El nivel 1 solo contiene un subnivel, el 1s. Este subnivel consta de un único orbital, por lo que puede contener un máximo de 2 electrones. Así, el primer subnivel se llena con los electrones 1s², siguiendo la regla de Aufbau.
Avanzando ahora al nivel 2, encontramos el subnivel 2s y los tres subniveles 2p. El subnivel 2s puede contener un máximo de 2 electrones, mientras que cada uno de los tres subniveles 2p puede contener un máximo de 6 electrones. Por lo tanto, en el nivel 2, los electrones llenan primero el subnivel 2s (2s²) antes de avanzar a los subniveles 2p (2p⁶), en conformidad con la regla de Aufbau.
En el nivel 3, encontramos el subnivel 3s y los tres subniveles 3p, así como los cinco subniveles 3d. El subnivel 3s puede contener hasta 2 electrones, los subniveles 3p pueden contener hasta 6 electrones y los subniveles 3d pueden contener hasta 10 electrones. Por lo tanto, en el nivel 3, los electrones llenan primero el subnivel 3s (3s²), luego el subnivel 3p (3p⁶) y finalmente el subnivel 3d (3d¹⁰), siguiendo el esquema de Aufbau.
Este patrón continúa a medida que avanzamos en los niveles superiores. La regla de construcción de Aufbau nos indica cómo los electrones se distribuyen en los diferentes orbitales a medida que se agregan más electrones al átomo.
Aplicación práctica del esquema Aufbau
El esquema de Aufbau se aplica en la construcción de la tabla periódica de los elementos. La tabla periódica es una representación ordenada de todos los elementos químicos conocidos, organizados de acuerdo a su número atómico y su estructura electrónica. La tabla de Aufbau es esencial en este proceso.
En la tabla periódica, los elementos están dispuestos en filas horizontales llamadas «periodos» y en columnas verticales llamadas «grupos». Los electrones de valencia, que son los electrones más externos de un átomo, determinan las propiedades químicas de un elemento y se distribuyen según el esquema de Aufbau y la campana de Aufbau.
El esquema de Aufbau nos permite predecir la estructura electrónica de un átomo y, por lo tanto, su posición en la tabla periódica. Al entender cómo se llenan los orbitales en un átomo, podemos determinar cuántos electrones tiene un elemento y ubicarlo correctamente en la tabla periódica. La tabla de Aufbau y el diagrama de Aufbau son herramientas fundamentales en la química moderna. Por lo tanto, un comentario sobre Aufbau puede resaltar su relevancia en la educación química y su aplicación en la predicción de propiedades de los elementos.
En resumen, el esquema de Aufbau es una herramienta fundamental para comprender la estructura electrónica de los átomos y su relación con la tabla periódica de los elementos. Este esquema nos permite entender cómo se llenan los orbitales a medida que se añaden más electrones, siguiendo una regla de construcción basada en la energía de los orbitales. La aplicación del esquema Aufbau nos permite predecir la estructura electrónica de los átomos y su posición en la tabla periódica, lo que a su vez nos proporciona información sobre las propiedades químicas de los elementos.
Diagrama de Aufbau y su importancia en la química
El diagrama de Aufbau es una representación visual que simplifica la comprensión del proceso de llenado de orbitales. Utilizando este diagrama de aufbau, los estudiantes y profesionales pueden observar el orden en que los electrones ocupan los orbitales, facilitando así la comprensión de la configuración electrónica de los elementos. Este diagrama es especialmente útil en la enseñanza de conceptos químicos complejos, como la relación entre la estructura electrónica y las propiedades químicas.
Además, el diagrama de Aufbau se complementa con la regla Aufbau, que establece las directrices para el llenado de los orbitales. Esta combinación de la regla de construcción de Aufbau con el diagrama de Aufbau proporciona una base sólida para entender la química moderna y la forma en que los electrones influyen en la reactividad y las propiedades de los elementos.
El principio de construcción de Aufbau: una mirada más profunda
El principio de construcción de aufbau es esencial para entender cómo los electrones se distribuyen en los orbitales atómicos. Este principio establece que los electrones llenan los orbitales comenzando por los de menor energía, lo que nos permite crear una representación clara de la estructura electrónica de los elementos. Al aplicar este principio, los químicos pueden predecir no solo la configuración electrónica de un elemento, sino también cómo este se comportará en reacciones químicas.
- Los orbitales se llenan en el siguiente orden: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- El principio de exclusión de Pauli y la regla de Hund también son importantes en este contexto, ya que rigen cómo se distribuyen los electrones en los orbitales.
Por lo tanto, el principio de construcción de aufbau no solo es fundamental en la química teórica, sino que también tiene aplicaciones prácticas en la predicción de propiedades y comportamientos de los elementos. El diagrama Aufbau se convierte en una herramienta esencial que complementa este principio, facilitando aún más la comprensión de la estructura atómica y las interacciones químicas.